
干货丨初中化学物质的除杂、鉴别知识清单,拿
一
除杂原则
1.不增:不引入新的杂质。
2.不减:提纯或分离的物质不能转变成其他物质,不减少被提纯的物质。
3.易分:杂质易分离。
4.复原:被保留的物质应能恢复原状。
二
除杂方法
1.物理方法
(1)过滤:适用于固体与液体混合物的分离,可溶性固体与不溶性固体混合物的分离。如:粗盐提纯。
(2)结晶:
蒸发:适用分离溶质与溶剂,除去可挥发的杂质,从含有HCl的NaCl溶液中分离出固体NaCl。
降温:可溶性固体溶质的溶解度受温度影响大小不同,从含NaCl杂质的KNO3中提纯KNO3。
2.化学方法
(1)转化法:将固、液、气体中的杂质转化为被提纯物质。
(2)沉淀法:将杂质转变为沉淀而除去。
(3)气化法:将固、液体中的杂质转变为气体而除去。
(4)加热法:杂质受热易分解,通过加热将杂质除去。
(5)溶解法:将固体中的杂质转变为可溶物而除去。
(6)置换法:类似于转化法,选用合适的试剂将杂质置换出来而除去。
3.除杂示例
(1)除去CuO中的C:在氧气流中灼烧。
(2)除去CO中的CO2:使混合气体通过氢氧化钠溶液
2NaOH+CO2=Na2CO3+H2O
(3)除去CO2中的CO:使混合气体通过灼热的氧化铜。
(4)除去CaO中的CaCO3:高温煅烧。【注意】不能加稀盐酸,因为CaO能与稀盐酸中的水反应生成Ca(OH)2。
(5)除去Cu中少量的Fe:物理方法——用磁铁反复吸引。化学方法——滴加稀盐酸或稀硫酸,然后过滤。【注意】不能加硫酸铜溶液,否则容易导致除杂不彻底。
(6)除去FeSO4溶液中的CuSO4:加入铁粉(铁丝);过滤。
总结:
(1)除去可溶物中的不溶物:溶解;过滤;蒸发结晶。
(2)除去不溶物中的可溶物:溶解;过滤。
(3)将两种可溶物分离:见“溶液”单元的冷却热饱和溶液法和蒸发溶剂结晶法。
(4)在溶液中,杂质有盐的时候,可以考虑把盐变成水、气体、沉淀。
三
除杂清单
1.气体的除杂
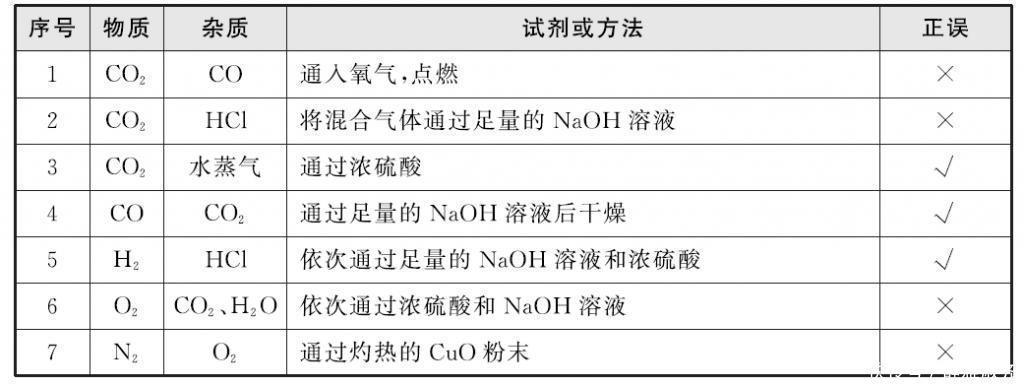
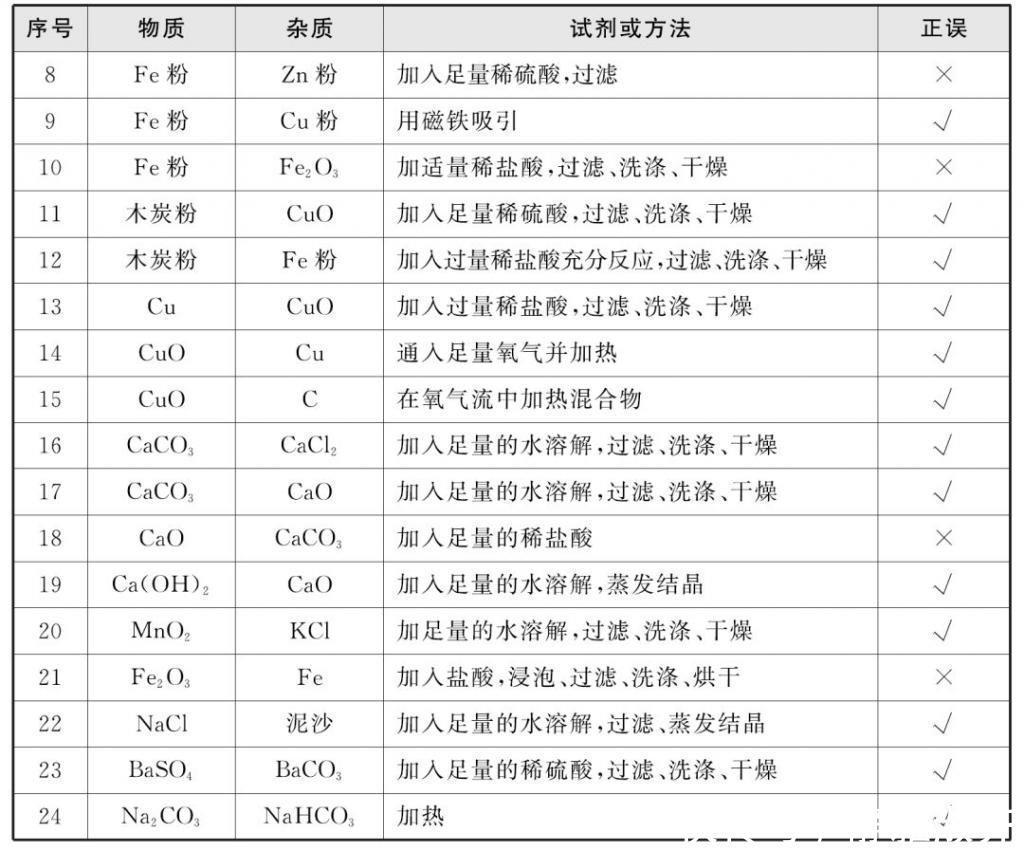
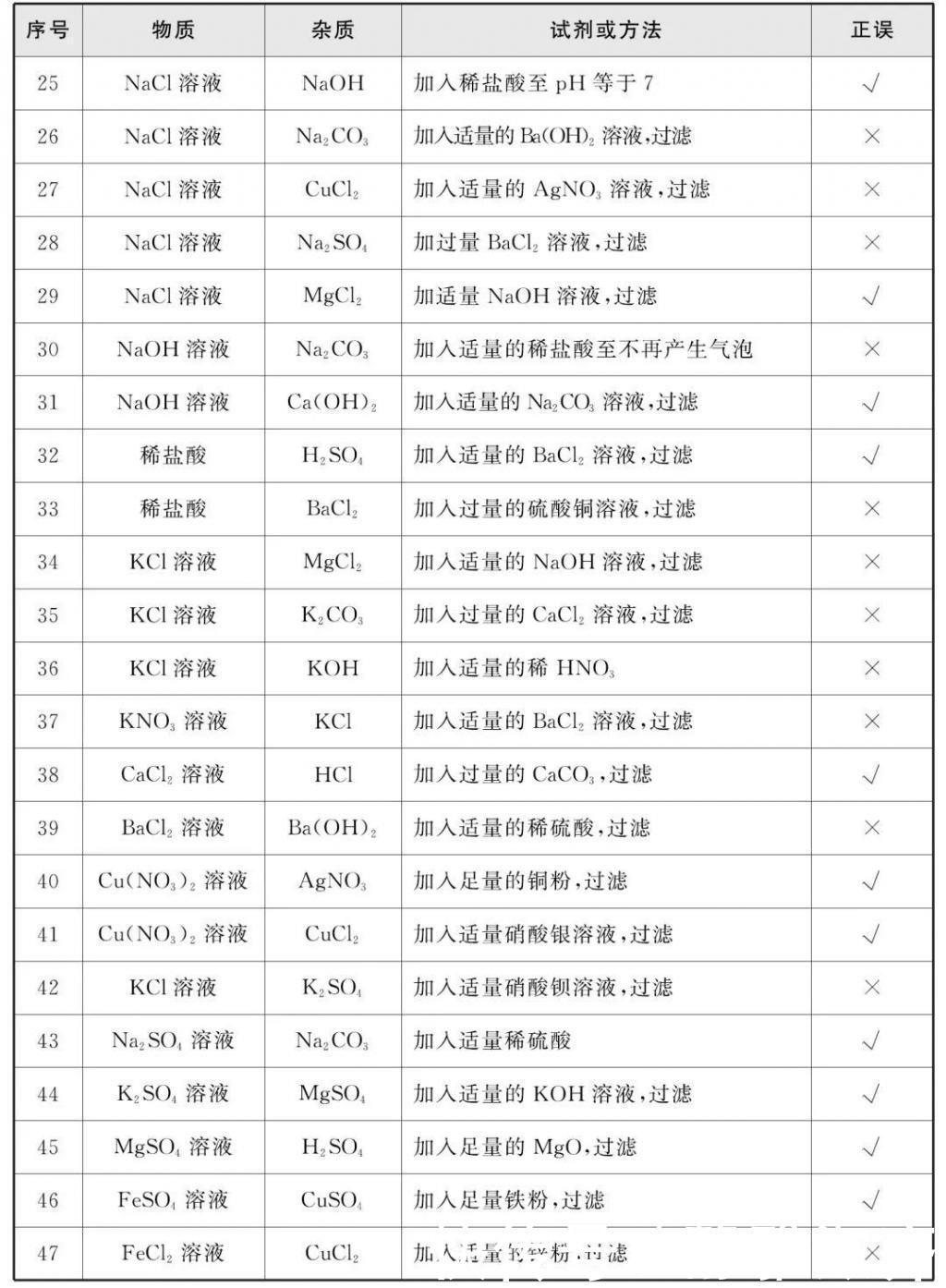
鉴定的常见方法
1.氧气的鉴定方法:
把一根带火星的木条伸入集气瓶中,如果带火星的木条复燃,证明是氧气。
2.氢气:
点燃,气体会发出淡蓝色火焰。如果气体较纯,气体将会安静地燃烧,并发出“噗”声;如果气体不纯,会发出尖锐爆鸣声。
3.二氧化碳:
把气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,就证明收集的气体是CO2。
4.三大可燃性气体的鉴定:
点燃,通过无水硫酸铜CuSO4,再通过澄清的石灰水(顺序不能颠倒!)
H2:生成物能使无水硫酸铜变蓝,但不能使澄清石灰水变浑浊。
CO:生成物不能使无水硫酸铜变蓝,但能使澄清的石灰水变浑浊。
CH4:生成物既能使无水硫酸铜变蓝,又能使澄清石灰水变浑浊。
【注意】不可以根据气体燃烧时的火焰颜色来鉴别气体。
5.水的鉴定:如果液体能使无水硫酸铜变蓝,说明液体中含有水。
6.碳酸根的鉴定:加盐酸,然后将产生的气体通入澄清石灰水。如果澄清的石灰水变浑浊,说明有碳酸根离子。
7.鉴定CaO是否含CaCO3加盐酸。
8.鉴定Cl-:先加入AgNO3溶液,再加入稀硝酸。如果有沉淀生成,说明含有Cl-。
9.鉴定SO42-:先加入Ba(NO3)2溶液,再加入稀硝酸。如果有沉淀生成,说明含有SO42-。
10.鉴定CO32-:加入稀盐酸,将产生的气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明含有CO32-。
11.鉴定HCO3-:同上。
12.鉴定Cu2+:加入NaOH溶液,如果有蓝色沉淀,说明含有Cu2+。
13.鉴定Fe3+:加入NaOH溶液,如果有红褐色沉淀,说明含有Fe3+。
14.鉴定H+:
借助石蕊或pH试纸。如果石蕊变红或用pH试纸测出的pH值小于7,说明含有H+。
加入碳酸盐(如CaCO3),将产生的气体通入澄清的石灰水中,如果澄清的石灰水变浑浊,说明含有H+。
加入活泼金属,如果金属表面产生气泡,并且产生一种可燃性气体(点燃之后安静燃烧,发出淡蓝色火焰。如果气体不纯,会发出尖锐的爆鸣声),说明含有H+。
加入Fe2O3(铁锈),如果铁锈逐渐溶解消失,溶液由无色变成黄色,说明含有H+。
加入难溶碱,如果逐渐溶解消失(如果加入Fe(OH)2、Fe(OH)3、Cu(OH)2,溶液的颜色还会发生变化),说明含有H+。
下一篇:没有了
